Примеси, загрязняющие буровой раствор
Во время бурения и цементирования скважины буровой раствор может загрязнятся различными материалами.
Наиболее распространенными являются следующие:
Хлорид натрия (поваренная соль) попадает в систему бурового раствора в результате разбуривания соляных куполов, пластов каменной соли, или любых пластов содержащих соленую воду. Загрязнение приводит к увеличению вязкости, ПНС и прочности геля, понижению водородного показателя рН. В этом случае параметры буревого раствора регулируются путем добавления разжижителей, а для повышения рН в раствор добавляют каустиническую соду.
Ангидрит и гипс являются формами сульфата кальция (СаSO4). Гипс содержит воду (СаSO4 •Н2О), а ангидрит нет (СаSO4). При контакте с буровым раствором повышается пластическая вязкость, ПНС и прочность геля. Методы борьбы заключаются в добавлении каустической соды и хромлигносульфонатов.
Цемент проникает в буровой раствор вследствие неудачного цементирования или при цементировании под давлением. В этом случае повышается пластическая вязкость, ПНС и прочность геля. В этом случае в буровой раствор добавляют бикарбонат натрия, который при контакте с цементом осаждает нерастворимый осадок в виде карбоната кальция: NaHCO3+Ca(OH)2→CaCO3+NaOH+H2O.
Оборудование для регулирования параметров раствора
Буровой раствор готовят путем смешения воды (или нефти) с бентонитом, баритом или различными другими химическими реагентами, чтобы получить флюид с соответствующими свойствами суспензии и текучести. В процессе бурения буровой раствор диспергируется и выносит буровой шлам, изменяющий его первоначальные свойства. Если этот шлам не удалить то буровой раствор потеряет требуемые свойства, что повлечет за собой сбои в работе (например, поглощение раствора).
Назначение оборудования для регулирования параметров раствора – обработка раствора, выходящего из скважины, путем удаления нежелательной вырубленной пароды и, если необходимо, добавление твердой фазы и химических реагентов. На Рис. 7 приведена схема полного комплекта оборудования не утяжеленных и утяжеленных (например, баритом) растворов.
Комплект системы регулирования параметров бурового раствора можно разделить на три секции:
1) приемный резервуар, содержащий кондиционный буровой раствор, который будет закачен в скважину;
2) секция добавления в раствор реагентов и смешения раствора;
3) секция удавления из раствора нежелательной твердой фазы.
3. уравнения гидромеханики (МСС) [1]
Кинематика сплошной среды
Общая задача кинематики – описание движения среды. Так как сплошная среда представляет собой непрерывную совокупность точек, то описание движения среды — значит, описать движение всех ее точек.
Существует два исторически сложившихся способа задания движения – Лагранжа и Эйлера.
Способ Лагранжа заключается в задании кинематических уравнений движения в виде совокупности переменных Лагранжа (xi, t):


Здесь, текущее координата xi определяется координатами фиксированной точки среды xi и временем t.
Основная задача МСС – определение закона движения (2.1).
Задание движения проекции скоростей и ускорений точек среды на оси координат определяются как:


Способ Эйлера заключается в задании переменных скорости и ускорения как функции переменных Эйлера — координат точек пространства xi и времени t:


Основное различие между методами Лагранжа и Эйлера состоит в том, что с точки зрения Лагранжа нас интересуют законы изменения положения, скорости, ускорения и других величин данной индивидуальной точки сплошной среды, а с точки зрения Эйлера – перемещение, скорость, ускорение и т.д. в точке пространства, мимо которой в данный момент проходит частица.
В настоящее время наиболее применяемым способом является способ Эйлера.
Запись уравнения движения среды в переменных Эйлера позволяет записать изменения расчетной (искомой) функции в виде:

Здесь 


Источник
УСТОЙЧИВОСТЬ К ЗАГРЯЗНЯЮЩИМ ПРИМЕСЯМ
Обработка бурового раствора при загрязнении цементом:
1. Увеличение концентрации дефлоккулянтов в буровом растворе. Лигносульфонат и лигнит действуют эффективно в присутствии кальция в широком диапазоне рН. При необходимости дополнительного контроля водоотдачи можно применить TANNATHIN®, RESINEX® и XP-20K™, которые весьма эффективны в среде с большим уровнем кальция. Большинство проблем, вызванных загрязнением цемента, решаются достаточно легко именно таким образом. Однако при проходке большого количества цемента буровой раствор необходимо обработать так, чтобы снизить содержание извести (если это позволит температурный режим).
2. Когда цемент становится растворимым, он повышает щелочность. Поэтому необходимости в добавлении каустической соды вместе с дефлоккулянтами нет. Низкий рН дефлоккулянтов, таких как лигнит и SAPP, компенсирует влияние гидроксил-ионов, образовавшихся при растворении цемента. Это способствует снижению pH и Pm, что повышает растворимость цемента (и кальция), в результате чего образуется осадок.
3. Свободный кальций можно осадить из раствора бикарбонатом натрия или кислым пирофосфатом натрия. Существуют разные точки зрения относительно того, какой из этих химреагентов наиболее эффективен, однако и бикарбонат натрия, и SAPP в равной степени снижают рН и Pm.
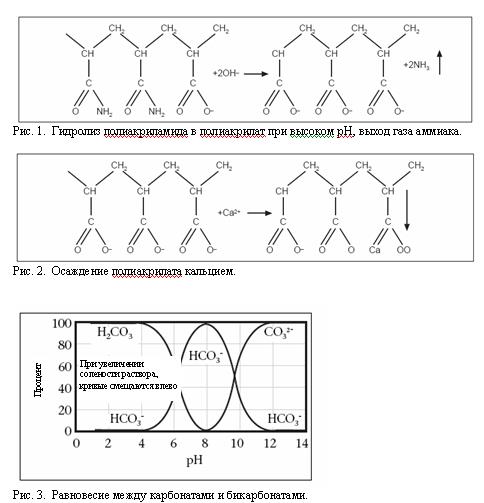
4. Если разбуривание цемента ведется на полимерном растворе, в таком растворе будет иметь место гидролизация полимеров из-за высокого рН и осаждение полимеров кальцием (см. Рис. 1 и 2). Поэтому необходимо снизить уровень рН и срочно удалить кальций (Ca 2+ ) из раствора осаждением.
5. В этом случае в раствор вводится лимонная кислота (H3C6H5O7). Лимонная кислота осаждает цемент в виде цитрата кальция и снижает рН. Реакция при обработке раствора лимонной кислотой имеет следующий вид:
6. Еще один метод борьбы с загрязнением бурового раствора цементом – применение механических систем очистки для удаления мелких частиц цемента. В этом случае цемент удаляется еще до того, как он может раствориться при низком рН.
Рис. 1. Гидролиз полиакриламида в полиакрилат при высоком рН, выход газа аммиака.
Рис. 2. Осаждение полиакрилата кальцием.
Бикарбонат натрия – отличное средство для борьбы с загрязнением раствора, так как бикарбонат осаждает кальций и снижает уровень рН. В зависимости от рН раствора, бикарбонат натрия образует ионы карбоната (CO3 2– ) и бикарбоната (HCO3 – ), которые осаждают кальций путем образованием карбоната кальция (известняка) как показано ниже:
При добавлении бикарбоната снижается уровень рН. Это – результат реакции HCO3 с NaOH, которая необходима для преобразования HCO3 в CO3. При использовании двууглекислого натрия целью является введение в раствор источника ионов карбоната и бикарбоната для реакции с избыточной известью и ионами кальция. Зачастую при использовании этого метода обработки раствора возникают осложнения из-за передозировки карбоната. Если концентрация карбонатов превышает уровень, необходимый для осаждения кальция, возможно загрязнение бурового раствора карбонатами. Поэтому лучше всего сперва добавить лишь небольшое количество карбонатов и понаблюдать за характеристиками раствора. Еще один подход к обработке цемента – использование фосфата SAPP (кислый пирофосфат натрия). Фосфаты хорошо удаляют кальций и способствуют дефлоккуляции загрязненного раствора. Используемые для обработки фосфаты при температуре выше ±200°F преобразуются в ортофосфаты. Ортофосфаты не так эффективны в качестве дефлоккулянтов, однако они все еще способны удалять из раствора кальций. Дополнительный эффект использования фосфатов заключается в снижении рН, Pf и Pm. У кислого пирофосфата натрия рН равен 4,8; у PHOS – 8,0.
Еще одно преимущество фосфатов заключается в отсутствии побочных продуктов реакции, которые могут привести к дополнительным осложнениям. При необходимости снижения уровня Pm лучше воспользоваться кислым пирофосфатом натрия. При проходке большого количества цемента может потребоваться обработка бурового раствора какой-либо кислотой. Даже при использовании бикарбоната уровень рН может превысить допустимые пределы, поэтому в таких случаях буровой раствор обрабатывают лимонной кислотой, кислым пирофосфатом натрия, уксусной кислотой, лигнитом с низким рН или лигносульфонатом.
Примечание: из-за высокого уровня рН кальцинированная сода при обработке загрязненного цементом раствора не применяется.
Загрязнение карбонатами
Химическое загрязнение бурового раствора растворенными карбонатами – одна из самых сложным и наименее изученных проблем нашей отрасли. В результате загрязнения карбонатами и бикарбонатами увеличивается вязкость, ДНС и СНС; такое загрязнение может привести к отвердению бурового раствора. Увеличение вязкости может наблюдаться при флоккуляции глинистых частиц раствора под действием карбонатов или бикарбонатов.
Источниками карбонатов и бикарбонатов являются:
1. Углекислый газ (СО2), попавший в буровой раствор из атмосферы через перемешиватели бурового раствора в емкостях и на выходах системы очистки и системы приготовления раствора. При растворении СО2 образуется углекислота (H2CO3), которая распадается на бикарбонаты (HCO3) и/или карбонаты (CO3) в зависимости от уровня рН раствора.
2. Передозировка кальцинированной соды или двууглекислой соды при обработке бурового раствора, загрязненного цементом или гипсом.
3. Вторжение углекислого газа (СО2) из пласта или пластовой воды.
4. Бикарбонаты или карбонаты, являющиеся побочными продуктами разложения лигносульфоната и лигнита под воздействием высоких температур (выше 325°F).
5. Барит, в котором иногда содержатся ионы карбоната или бикарбоната.

Графически эти реакции проиллюстрированы на Рис.3, показывающем распределение углекислоты (H2CO3), бикарбоната (HCO3) и карбоната (CO3) от уровня pH.
Рис. 3. Равновесие между карбонатами и бикарбонатами.
Источник
ГЛАВА 4С. ЗАГРЯЗНЕНИЕ И ОБРАБОТКА БУРОВЫХ РАСТВОРОВ.
ВВЕДЕНИЕ
Загрязняющей примесью может быть любое вещество (твердое, жидкое или газообразное), которое ухудшает физические или химические параметры бурового раствора. Одно и то же вещество для различных буровых растворов может быть и загрязняющей примесью, и его составной частью. Загрязняющими примесями для всех типов буровых растворов является легкая и химически активная твердая фаза. Легкая твердая фаза состоит либо из бурового шлама, перемешавшегося с буровым раствором, либо из глинопорошков промышленного изготовления при передозировке. С экономической точки зрения, в сравнении с другими видами загрязнения на стоимости бурового раствора сильнее всего сказываются расходы на очистку раствора от выбуренной породы и связанные с этим осложнения. И все же в начале данной главы основное внимание уделяется перечисленным ниже веществам, которые для растворов на водной основе являются загрязняющими примесями:
2. Цемент (сложный силикат Ca(OH)2).
3. Соль (каменная соль, вода для приготовления раствора, морская вода, хлориды магния, кальция и натрия, связанная вода).
4. Кислые газы, включая углекислый газ (СО2) и сероводород (H2S).
За исключением кислых газов, все перечисленные химические соединения напрямую вовлечены в реакции ионного обмена с глинами. Поэтому концентрация частиц глины в буровом растворе на водной основе напрямую влияет на степень отрицательного воздействия загрязняющей примеси на параметры раствора.
Емкость катионного обмена по метиленовой сини (англ. сокр. MBC) – хороший показатель концентрации частиц глины. Растворы с уровнем MBC ниже 15 фунтов/баррель наименее подвержены химическому загрязнению. Реакция ионного обмена происходит при контакте натриевого бентонита с химической средой с высокой концентрацией ионов некоторых металлов. Сперва происходит флоккуляция, затем, возможно, происходит химическое преобразование бентонита в глину с более низким выходом. Это влияет на количество адсорбированной воды и размер, форму и ассоциацию частиц глины, в результате чего становится труднее контролировать реологические параметры и водоотдачу.
Серьезность проблемы заставила инженеров разработать такие системы буровых растворов, которые могли бы оказаться устойчивыми к загрязнениям. Среди таких растворов – лигносульфонатные растворы, низкоколлоидные полимерные растворы, щелочные растворы, гипсовые или солевые растворы. Многие из указанные растворов подвергались предварительной обработке лигносульфонатом, солью (хлоридом натрия) или материалами, содержащими кальций (известь или гипс). Поэтому дальнейшее повышение концентрации этих загрязняющих веществ не сильно сказывается на параметрах раствора.
Основные цели данной главы:
· Рассказать об источниках загрязнений.
· Описать влияние различных загрязняющих веществ на свойства раствора.
· Рассказать о том, как изменения некоторых параметров буровых растворов позволяют определить наличие загрязняющей примеси.
· Рассказать об обработке бурового раствора для восстановления первоначальных параметров.
Так как изменения физических параметров раствора (реологические или фильтрационные характеристики при флоккуляции) одинаковы вне зависимости от типа загрязняющего вещества, сами по себе изменения физических параметров смогут лишь указать на факт загрязнения. Для определения загрязняющей примеси необходимо провести анализ изменения химических свойств раствора. Далее приводится подробное описание источников загрязнений, воздействия загрязняющих примесей и методы борьбы с каждым видом загрязнения. В конце главы приводится краткий справочник и таблицы преобразований метрических и английских единиц измерения (см. Табл. 2,3 и 4).
Источник



